ΥΠΟΛΟΓΙΣΜΟΣ ΤΗΣ
ΕΝΘΑΛΠΙΑΣ ΕΞΟΥΔΕΤΕΡΩΣΗΣ ΜΕ ΧΡΗΣΗ ΤΟΥ
ΣΥΣΤΗΜΑΤΟΣ ΣΥΓΧΡΟΝΙΚΗΣ ΛΗΨΗΣ ΚΑΙ
ΑΠΕΙΚΟΝΙΣΗΣ (Σ.Σ.Λ.Α)
(
Ευθύμιος ΠαπαευσταθίουΥπ. ΕΚΦΕ Αχαρνών -Διονύσης
Βαλλιάνος ΕΚΦΕ
Γέρακα –
Δυο λόγια για το σύστημα Μultilog
Το
σύστημα Μultilog ή Σύστημα
Συγχρονικής Λήψης και Απεικόνισης:
Στόχοι
Οι μαθητές:
ü
Να
εξασκηθούν στην παρατήρηση της μεταβολής
της θερμοκρασίας κατά τη διάρκεια της
εξουδετέρωσης.
ü
Να
μπορούν να υπολογίσουν πειραματικά την
ενθαλπία εξουδετέρωσης.
ü
Να
συγκρίνουν τα πειραματικά αποτελέσματα με αυτά που προβλέπει η θεωρία.
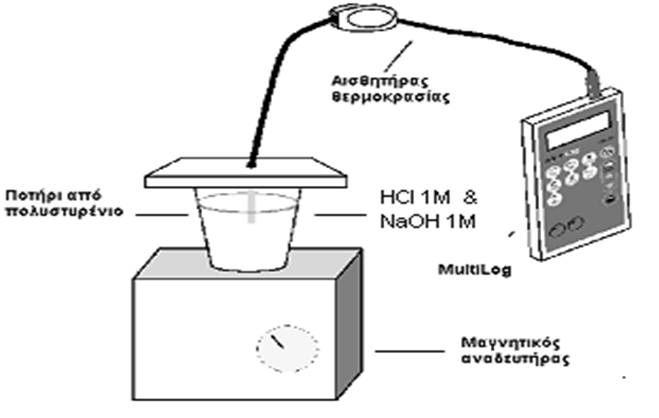
Όργανα-Αντιδραστήρια
|
α/α |
ΟΡΓΑΝΑ
|
ΑΝΤΙΔΡΑΣΤΗΡΙΑ
|
|
1 |
Υπολογιστής |
Διάλυμα ΝαΟΗ 1Μ |
|
2 |
Κονσόλα
multilog |
Διάλυμα
HCl M |
|
3 |
Αισθητήρας
θερμοκρασίας |
|
|
4 |
Μαγνητικός
αναδευτήρας |
|
|
5 |
2
Ογκομετρικούσ κυλίνδρους
100 mL |
|
|
6 |
2
ποτήρια coffee
cups
μεγάλα |
|
|
7 |
Κάλυμμα
ποτηριού από φελιζόλ |
|
|
8 |
Υδροβολέας |
|
|
9 |
|
|
1. Με
τη βοήθεια του ογκομετρικού κυλίνδρου
μετράμε 50mL
διαλύματος HCl
1M
και το προσθέτουμε
3.
Τοποθετούμε το ποτήρι πάνω στο
μαγνητικό αναδευτήρα και ανοίγουμε το
ποτενσιόμετρο ώστε το μαγνητάκι να
στρέφεται με αργό ρυθμό.
4.
«Ανοίγουμε»
το Multilog
(πατάμε το ON)
και συνδέουμε στην κονσόλα του συστήματος
τον αισθητήρα
pH
στην θύρα Ι/Ο- 1 και
τον αισθητήρα θερμοκρασίας στην στην θύρα
Ι/Ο- 2.
5. Εμβαπτίζουμε στο
ποτήρι το θερμόμετρο που έχουμε περάσει από
μία οπή στο κέντρο του καλύμματος και
σκεπάζουμε το ποτήρι.
6.
Με
τη βοήθεια του ογκομετρικού κυλίνδρου
μετράμε 50mL
διαλύματος NaOH
1Μ.

Ενεργοποίηση
του Συστήματος Μultilog
2. Από το menu ΕΝΑΡΞΗ πηγαίνουμε στα ΠΡΟΓΡΑΜΜΑΤΑ μετά στο πρόγραμμα data logging, και τέλος στο DB-Lαb 3.2.
3. Όταν
ενεργοποιηθεί το πρόγραμμα επιλέγουμε
καταγραφέα
και πατάμε ρυθμίσεις
επικοινωνίας.
4. Στο
παράθυρο θύρα
επικοινωνίας, επιλέγουμε com1
και com2
και
πατάμε προσπάθεια
σύνδεσης.
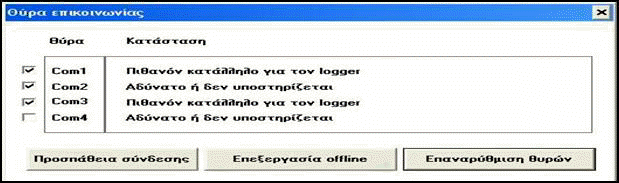
6. Στον
πίνακα ελέγχου θα πρέπει να εμφανίζεται στην
είσοδο1 : θερμοκρασία από
-25 έως 110
(αυτόματη αναγνώριση αισθητήρων).
Διαφορετικά ρυθμίζουμε στην
είσοδο1 την
θερμοκρασία από -25 έως
110. ( Την πρώτη κατά σειρά θερμοκρασία
που
βγαίνει στο πινακάκι της εισόδου 2).

Πειραματική
Διαδικασία
1.
Ρίχνουμε
γρήγορα το διάλυμα του υπεροξειδίου του
νατρίου στο ποτήρι και κλείνουμε το κάλυμμα
.
2.
Κλείνουμε
το μαγνητικό αναδευτήρα όταν τελειώσει η
καταμέτρηση .
ΕΞΟΥΔΕΤΕΡΩΣΗ
ΙΣΧΥΡΟΥ ΟΞΕΟΣ ΜΕ ΙΣΧΥΡΗ ΒΑΣΗ
ΦΥΛΛΟ ΕΡΓΑΣΙΑΣ
|
ΟΝΟΜΑΤΕΠΏΝΥΜΟ
:…………………………………………………………………. |
|
ΤΜΗΜΑ:…………………………………………………………………………………. |
|
ΗΜΕΡΟΜΗΝΙΑ:…………………………………………………………………………. |
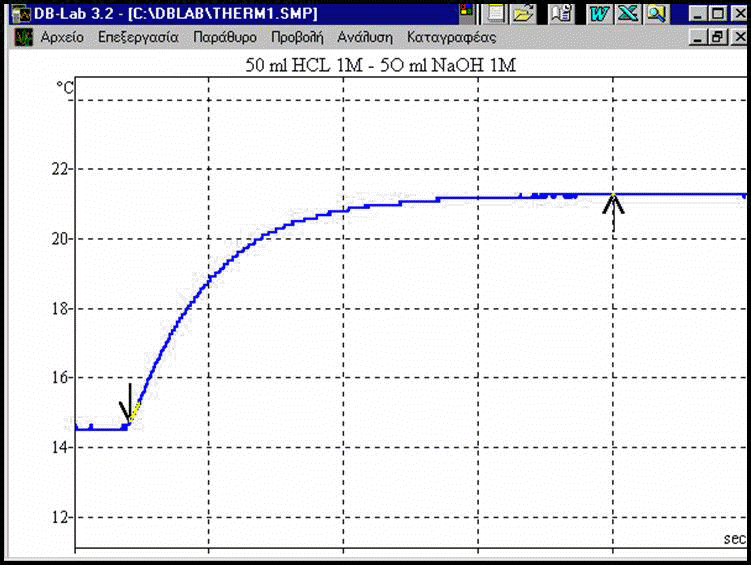
ΥΠΟΛΟΓΙΣΜΟΣ ΤΗΣ
ΕΝΘΑΛΠΙΑΣ ΕΞΟΥΔΕΤΕΡΩΣΗΣ
|
Aρχική
θερμοκρασία |
θ1
= ……….. οC |
|
Τελική
θερμοκρασία ( η μεγαλύτερη ) |
θ2
=………. οC |
|
Μεταβολή
θερμοκρασίας |
Δθ
= ……… οC |
|
Μάζα Δ. ΝαΟΗ
( ρ =1 g/mL) |
m ΝαΟΗ =50 g |
|
Μάζα Δ.
HCl
( ρ =1 g/mL) |
m HCl
=50 g |
|
Ολική μάζα
διαλύματος |
m ολ
=100 g |
|
Θερμότητα
αντίδρασης (cal) |
Q1 = m ολ · c · Δθ
=…………..cal c= 1cal /g ·grad |
|
Θερμότητα
αντίδρασης (J) |
Q2 =………….. J 1cal =4.18 J |
|
Moles
NαOH (1M) |
n= C· VNaOH
= 0,05 moles |
|
Eνθαλπία
εξουδετέρωσης |
ΔHn=
Q2 / n
= ……….. J/mol |
1.
Η χημική αντίδραση της εξουδετέρωσης
είναι ενδόθερμη ή εξώθερμη
αντίδραση;
…………………………………………………………………………………………….
…………………………………………………………………………………………….
…………………………………………………………………………………………….
…………………………………………………………………………………………….
……………………………………………………………………………………………